

SEMI-CONDUCTEURS 1

Dans cette leçon, nous commencerons à nous occuper des semi-conducteurs, matériaux qui ont permis de réaliser d'importants dispositifs (diodes, transistors, circuits intégrés...) en mesure d'assurer des fonctions multiples et complexes.
Pour comprendre parfaitement le fonctionnement des dispositifs à semi-conducteurs, il est nécessaire de bien connaître la structure des matériaux utilisés pour leur fabrication.
Nous commencerons par un rapide examen de la structure interne des cristaux.
Tout au long de ce développement, on aura souvent recours à des figures pour représenter d'une façon analogique les phénomènes qui se produisent dans les semi-conducteurs. Le recours à ces figures est utile toutes les fois qu'il n'est pas possible de visualiser directement le phénomène à étudier. Même si cette représentation est toujours approximative et ne reproduit pas fidèlement le phénomène, elle peut toutefois, d'une certaine façon et pour un temps donné, représenter du mieux possible les phénomènes connus.

Toutes les expériences de chimie démontrent que les atomes de corps différents, s'attirent ou se repoussent, lorsqu'ils sont placés à petite distance les uns des autres.
Il faut préciser tout de suite que lorsqu'il s'agit de distance entre atomes, on utilise comme unité de mesure l'angström (symbole Å ) équivalent au dix millionième de millimètre ou le millimicron (symbole mµ) correspondant au millionième de millimètre.
L'attraction qui se manifeste entre les atomes est appelée attraction de VAN DER WAALS ; elle est en général relativement faible et ne commence à s'exercer que lorsque les atomes sont à des distances de quelques angströms (figure 1).

A plus faible distance, lorsque les orbites externes des électrons se touchent, il peut s'établir un lien plus étroit, appelé lien chimique, ou au contraire il peut se produire une force répulsion.
L'attraction de VAN DER WAALS est essentiellement un phénomène de nature électrostatique, dû à la force électrique d'attraction, s'exerçant entre le noyau électriquement positif et les électrons de l'atome voisin, électriquement négatifs.
Le lien chimique et la répulsion sont au contraire dus à la constitution de la dernière couche des électrons, tournant autour du noyau, c'est-à-dire la couche externe. En général, les couches internes des électrons sont stables et ne sont pas concernées par les phénomènes chimiques et électriques.
La couche externe au contraire peut présenter une certaine instabilité, car elle peut perdre ou gagner des électrons ou encore les mettre en commun avec les électrons de la couche externe d'un atome voisin.
Pour expliquer la formation du lien chimique dans certains cas et dans d'autres la répulsion, il faut se référer à un principe physique, connu sous le nom de principe de PAULI.
D'après ce principe, dans chaque orbite électronique placée autour du noyau d'un atome, il ne peut y avoir qu'un électron ayant une énergie déterminée. Cependant, si l'on admet que tous les électrons sont exactement égaux entre eux et, qu'un électron sur son orbite tourne aussi sur lui-même dans un sens ou dans l'autre, on peut modifier l'expression précédente du principe de PAULI et écrire : sur l'orbite d'un noyau, il ne peut tourner plus de deux électrons et ces derniers tournant sur eux-mêmes, doivent tourner en sens inverse l'un de l'autre (principe de PAULI généralisé sur lequel nous nous baserons dans les explications qui suivent).
Nous admettrons ce principe sans le démontrer car il nécessite des connaissances très profondes en physique nucléaire sortant du cadre de cette leçon.
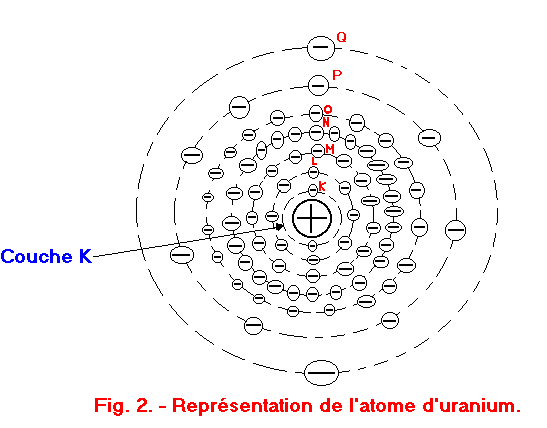
Imaginons maintenant que deux atomes d'hydrogène se rapprochent l'un de l'autre. On peut représenter les atomes de l'hydrogène comme sur la figure 1 ; ils sont constitués d'un noyau et d'un seul électron tournant sur la couche K (figure 2 : atome d'uranium comportant ici 7 couches sur lesquelles gravitent des électrons ; la couche K dispose de 2 électrons dans cet exemple).
Lorsque les noyaux des deux atomes se trouvent à une distance de quelques angströms (5 Å environ), l'attraction de VAN DER WAALS commence à se manifester.
Si la distance diminue, l'attraction électrostatique augmente et à partir de 0,75 Å, le lien chimique intervient. Ce lien assure l'union stable des deux atomes et détermine ainsi la formation de la molécule d'hydrogène.
Le lien chimique n'est pas uniquement constitué par une forte attraction électrostatique entre le noyau et les électrons, mais aussi par un échange d'énergie entre les atomes, échange se produisant par l'intermédiaire des électrons passant successivement et indifféremment de l'orbite d'un atome à l'orbite d'un autre atome.
Lors du continuel passage des électrons d'un atome à l'autre, il arrive évidemment que sur l'orbite d'un atome d'hydrogène il se trouve deux électrons au lieu d'un.
Cette possibilité est évoquée dans le principe de PAULI généralisé puisque dans chaque orbite on peut trouver deux électrons.
Considérons maintenant un autre cas : imaginons que deux atomes d'hélium se sont rapprochés l'un de l'autre.
Les atomes d'hélium sont constitués d'un noyau et de deux électrons gravitant sur la couche K. Cette couche, c'est-à-dire la couche la plus proche du noyau est constituée d'une seule orbite.
Pour l'hélium, cette couche est complète, car elle comprend deux électrons et ne peut, d'après le principe de PAULI en accueillir d'autres.
Lorsque les noyaux des deux atomes d'hélium se trouvent à une distance de quelques angströms, l'attraction de VAN DER WAALS peut se manifester ; toutefois à une distance plus faible, il se produit une forte répulsion au lieu du lien chimique. Cette répulsion entre les deux atomes d'hélium est due aux interaction de leurs électrons. En effet, nous savons que les électrons ont tous la même charge et qu'ils se repoussent entre eux. D'autre part, il est impossible d'obtenir une répartition stable des électrons autour des deux noyaux comme dans le cas de l'hydrogène, car d'après le principe de PAULI généralisé, l'orbite de chaque atome d'hélium est considérée comme complète.
Nous n'avons jusqu'ici examiné que des atomes simples, ne comportant qu'une seule couche d'électrons, la couche K.
Dans le cas d'atomes à deux ou plusieurs couches (figure 2), il faut non seulement tenir compte du principe de PAULI mais aussi du fait que la stabilité maximale des électrons est obtenue, lorsque la couche externe comprend huit électrons gravitant sur quatre orbites.
Les éléments ayant huit électrons sur la couche externe sont réunis dans le groupe IX du tableau de MENDELEYEV donné figure 3.

Par contre, si un atome à moins de huit électrons dans une couche externe, différente de la couche K, il aura tendance à accepter le lien chimique avec d'autres atomes. Cette capacité de l'atome de se lier chimiquement avec d'autres atomes est dite valence. Il existe une certaine relation entre la valence d'un atome et le nombre d'électrons qui comprend sa couche externe.
Ce critère pour distinguer les valences n'est cependant pas toujours valable ; il y a même de nombreuses exceptions.
Par exemple, l'antimoine, l'arsenic et le phosphore ne possèdent que cinq électrons sur leur couche externe et peuvent par conséquent être trivalents d'après le critère ci-dessus, mais peuvent également avoir une valence cinq. Dans ce cas, ils sont dits pentavalents.
On trouve aussi des atomes pouvant avoir une valence six (hexavalents) et une valence sept (heptavalents).
Il n'est pas nécessaire d'approfondir le concept général de valence, concept lié à des recherches très complexes sortant du cadre de cette leçon, mais il est utile par contre de bien mettre en évidence le lien chimique entre les atomes d'un même élément.
Nous avons précédemment considéré le lien qui s'établit entre deux atomes d'hydrogène, lorsque leurs noyaux respectifs se trouvent à une distance de 0,75Å. Ce type particulier de lien chimique entre atomes de la même espèce est dit lien covalent ou encore lien homopolaire.
Voyons comment peut s'établir un lien covalent entre atomes, ayant plus de deux électrons et moins de huit dans leur couche externe.
Prenons par exemple quelques atomes d'un élément tétravalent, c'est-à-dire un élément possédant quatre électrons sur sa couche périphérique.
Pour simplifier la représentation, on a fait figurer sur le dessin de la figure 4-a que le noyau des atomes et les quatre électrons périphériques (les électrons des autres couches n'étant pas concernés).

Bien entendu, en réalité les quatre électrons périphériques de chaque atome, occupent plusieurs orbites, mais pour plus de clarté il suffit de n'en représenter qu'une seule.
Entre les électrons périphériques, on a aussi dessiné quatre trous, qui représentent les places libres, dans lesquelles pourraient venir quatre autres électrons, de façon à compléter la couche externe.
Le croquis de la figure 4-a peut représenter tous les atomes des éléments tétravalents classés dans le groupe IV du tableau de MENDELEYEV (figure 3), c'est-à-dire le carbone, le silicium, le titane, le germanium, le zirconium, l'étain, l'hafnium et le plomb.
Imaginons maintenant que quatre atomes tétravalents se rapprochent d'un atome du même type. Lorsque ces atomes se trouvent à quelques angströms, les forces de VAN DER WAALS se manifestent ; mais à de plus faibles distances il s'établit un lien covalent entre l'atome considéré et chacun des quatre atomes qui se sont rapprochés.
Les quatre liens covalents sont représentés figure 4-b par les quatre rayons en pointillés. Ce phénomène est facile à comprendre. En effet, au centre nous avons un atome instable avec quatre électrons sur la couche externe qui peut soit en récupérer, soit en céder.
A proximité de ces atomes, quatre autres atomes du même type se sont rapprochés jusqu'à ce que les orbites soient en contact les unes avec les autres.
Tout naturellement l'atome du centre comble donc ses quatre trous (voir figure 4-a) avec les électrons instables des quatre autres atomes.
L'atome du centre a ainsi sa couche externe complète avec huit électrons. En réalité, ces huit électrons n'appartiennent pas exclusivement au même atome ; ils se subdivisent en quatre couples et chaque couple d'électrons appartient manifestement à l'atome central et à un atome périphérique.
Le lien covalent, existant entre l'atome central et les quatre atomes périphériques, consiste en un échange répété d'énergie dû au passage d'électrons d'un atome à l'autre.

Le fonctionnement des transistors dépend des propriétés de la couche externe des atomes de certains corps, dits corps semi-conducteurs, mais il est basé sur l'état d'agrégation de ces corps.
Les caractéristiques physiques fondamentales des semi-conducteurs se manifestent exclusivement lorsque le matériau est à l'état solide.
Il faut en plus que ce matériau se trouve dans un état solide particulier dit état cristallin. C'est pour cette raison que les transistors ou les diodes à semi-conducteurs sont appelés des dispositifs à cristal.
L'état cristallin se distingue des autres états solides par le fait que les atomes occupent dans l'agrégat une position fixe selon un dessin géométrique répété, plus ou moins complexe.
Prenons par exemple un cristal très pur de chlorure de sodium (sel de cuisine).
Le chlorure de sodium est un composé constitué d'atomes de chlore et de sodium en parties égales. Si nous pouvions agrandir cinquante millions de fois un minuscule grain de chlorure de sodium, les atomes apparaîtraient comme sur la figure 5-a.
Cette disposition se répète, toujours égales à elle-même, à mesure qu'augmentent les dimensions du grain de cristal.

La structure réticulaire de la figure 5-a est fondamentale pour de nombreux types de cristaux. Il existe évidemment d'autres structures réticulaires cristallines de substances simples et composées.
On peut voir figure 5-b, la représentation du cristal de sélénium, substance simple employée dans la fabrication des redresseurs solides.
Les atomes, dans la structure cristalline de sélénium, sont disposés en spirales autour d'axes parallèles et celles-ci se regroupent en couches superposées.
Parmi les structures cristallines, celle du diamant a une grande importance dans l'étude des semi-conducteurs.
Le diamant (figure 6-a) est constitué d'atomes de carbone, disposés de telle sorte que chaque atome se trouve entouré par quatre autres, tous à égale distance de l'atome central et uniformément dans l'espace environnant (figure 6-b).

La distance d, entre l'atome central et les quatre atomes voisins est constante en tous points du réseau (cette distance est d'environ 2 angströms).
Les atomes de cristal sont maintenus ensemble par des liens covalents, du même type que ceux de la figure 4-b.
En nous rappelant ce qui vient d'être dit sur la nature de ce lien, nous pouvons comprendre que tout l'espace entre les atomes est occupés par une intense circulation électronique. Les électrons se promènent en effet dans les espaces vides du réseau cristallin, en passant d'une orbite à l'autre, mais ils ne sont jamais vraiment libres : ils restent toujours liés au réseau formé par les atomes auxquels ils appartiennent initialement. Ils ne pourraient pas, sous l'action d'un champ électrique extérieur, former un flux continuel de courant. En d'autres termes, cela signifie que le diamant est un mauvais conducteur d'électricité.
Pour représenter de façon plus simple la structure cristalline du diamant, on peut avoir recours à la représentation plane (figure 7).

Cette figure met mieux en évidence le fait que les distances entre atomes sont égales et permet de mieux comprendre l'existence des liens covalents.

On appelle semi-conducteurs, les substances dont la conductivité électrique est intermédiaire entre celle des conducteurs et celle des isolants.
L'oxyde de cuivre et le sélénium, utilisés dans certains types de redresseurs, sont des semi-conducteurs, de même que divers autres oxydes et sels métalliques, mais ce sont le germanium et le silicium qui ont le plus d'importance. La figure 8 représente l'atome de chacun de ces deux éléments.
On peut remarquer que pour ces deux corps, la couche externe des atomes ne comprend que quatre électrons.

Ces éléments sont donc du type tétravalent, comme le carbone pur (diamant).
Remarquons aussi que le carbone, le silicium et le germanium, appartiennent au même groupe dans la classification de MENDELEYEV (groupe IV, figure 3). Ainsi, tout ce qui a été dit sur le réseau cristallin du carbone et sur les liens covalents de ce corps reste valable pour le germanium et le silicium.
Cependant, en examinant le réseau cristallin du diamant, on a signalé que les électrons appartenant à la couche externe de chaque atome, vont d'une orbite à l'autre mais qu'ils restent liés et ne peuvent pas participer à la formation d'un courant électrique. Or, pour certains cristaux, la circulation électronique peut être influencée plus ou moins par des causes extérieures (un champ électrique par exemple) et dans ce cas de nombreux électrons peuvent se réunir en un flux de courant.
Cela signifie que l'on peut avoir des cristaux plus ou moins bon conducteurs d'électricité ou des cristaux isolants, comme le diamant.
Les cristaux de germanium et de silicium sont dans la première catégorie et nous allons voir comment se produit la conduction électrique.
Pour clarifier les explications, subdivisons les électrons des couches externes en deux catégories :

Les électrons de valence sont ceux, qui tout en se déplaçant d'un atome à l'autre, restent liés au réseau (comme dans le cas du diamant).
Les électrons de conduction sont ceux, qui pendant les divers déplacements, acquièrent assez d'énergie pour rompre les liens covalents.
Dans un cristal très pur, géométriquement parfait et maintenu à une température très proche du zéro absolu (- 273, 16°C), tous les électrons des atomes appartiennent à la catégorie des électrons de valence ou pour utiliser une expression courante en physique, appartiennent à la bande de valence.
En élevant la température ou sous l'effet d'une déformation du réseau ou encore en plaçant le cristal dans un champ électrique intense, une partie des électrons de valence gagne une certaine énergie et peut se libérer du réseau, c'est-à-dire passer de la bande de valence à la bande de conduction. Ce phénomène peut être plus ou moins important selon le type de cristal.
A la température de 18°C, pour le diamant ce phénomène est négligeable ; pour le germanium, un électron sur un milliard d'atomes passe de la bande de valence à la bande de conduction (un électron sur 4 milliards d'électrons de valence devient libre).
A première vue, en fonction des nombres donnés, on pourrait croire qu'un électron sur quatre milliards constitue une quantité négligeable. En réalité, il faut tenir compte du fait que dans un centimètre cube de germanium, il y a environ 1 x 1022 atomes, ce qui donne environ dix mille milliards d'électrons libres. Cette quantité n'est donc plus négligeable et suffit à rendre le cristal conducteur.
Mais que se passe-t-il dans un cristal où un électron est devenu libre ?
Cet électron se promène de façon désordonnée dans les espaces du réseau, contrairement aux électrons de valence qui parcourent les mêmes espaces sur des orbites bien définies. D'autre part, à partir du moment où le lien covalent est rompu et que l'électron laisse une place libre, il se créé un vide sur une orbite.
En un point du réseau, il existe donc un trou (on dit aussi cavité ou lacune).
Ce phénomène est mis en évidence sur la figure 9 où l'on peut voir quatre électrons libres (électrons de conduction) et aussi quatre trous portant les numéros 1 - 2 - 3 et 4. Le trou représente une charge électrique égale à celle de l'électron mais de signe inverse. En effet, l'atome est neutre avec tous ses électrons. S'il en perd un, cet électron libre représente une charge négative disponible ; mais l'atome n'est plus neutre puisqu'il a perdu un électron ; il acquiert donc une charge positive, charge provenant des protons dont l'influence n'est plus compensée par le même nombre d'électrons qu'à l'origine. (La figure 10 permet de mieux comprendre cette explication.

Ainsi, lorsque dans le cristal très pur il y a de nombreux électrons libres, il existe autant de trous. Il ne faut pas cependant croire que ces trous occupent une position immuable. En effet, dès qu'un trou vient d'être créé par fuite d'un électron, il est presque instantanément occupé par un électron de valence. Ce trou disparaît donc, mais ne reforme ailleurs dans la place laissée libre par l'électron de valence en question et ainsi de suite.
Nous pouvons donc retenir que les trous se déplacent d'un point à un autre du réseau, de façon imprévisible et désordonnée comme les électrons libres.
Le mouvement désordonné des électrons de conduction et des trous constituent l'aspect fondamental de la conductibilité électrique dans les semi-conducteurs.
Les figures 11 et 12 permettent de bien illustrer les phénomènes décrits précédemment.

L'échiquier de la figure 11-a représente le réseau d'un cristal semi-conducteur. Les pions se trouvant dans les cases blanches correspondent aux électrons de valence et le pion de la case noire à l'électron de conduction.
La case blanche vide représente le trou créé par l'électron libre lors de son passage de la bande de valence à la bande de conduction.
L'électron peut se déplacer de façon libre et désordonnée dans les espaces du réseau, tout comme le pion se trouvant dans la case noire peut être déplacé sur l'échiquier (figure 11-b). Dans le même temps, le trou se déplace de façon désordonnée ; son parcours n'est pas aussi simple que celui de l'électron libre. En effet, pour qu'un trou puisse changer de position, il faut qu'un électron de valence vienne l'occuper, laissant ainsi un nouveau trou libre ; exactement comme pour déplacer la case blanche libre de la figure 12-a, il faut qu'elle soit occupée par le pion d'une autre case blanche.

En répétant ce jeu avec d'autres pions (figure 12-b, 12-c et 12-d), la case blanche libre semble se promener de façon incohérente à travers l'échiquier, tout comme les trous dans le réseau du cristal.
En général, le mouvement d'un électron libre et celui d'un trou n'ont pas une durée limitée. En effet, en raison de l'agitation thermique de toutes les particules du cristal, l'électron libre à un moment donné, heurte un autre électron et perd ainsi son énergie. De ce fait, il est attiré par un trou qui cesse ainsi d'exister.
La figure 13 illustre le parcours effectué par un électron libre et par un trou.

L'électron part de A et suit par exemple le chemin représenté en pointillés de couleur vert pour arriver au point C. En principe, il se déplace le long de trajectoires rectilignes en changeant de direction toutes les fois qu'il heurte d'autres particules. Quant au trou, partant du point B et suivant la ligne en trait continu, il arrive lui aussi au point C où il disparaît, l'électron ayant perdu toute son énergie à la suite des chocs subis avec les particules.
Nous venons de voir jusqu'à présent les cristaux semi-conducteurs très pur et géométriquement parfaits dans lesquels le nombre des électrons libres est exactement égal au nombre de trous. Ces semi-conducteurs s'appellent des semi-conducteurs intrinsèques.
Pour utiliser ceux-ci afin de réaliser des transistors, il faut modifier leur structure par un traitement approprié.
